
Konsep unsur merupakan konsep yang sangat tua, sejak jaman Yunani, Menurut filsuf Yunani, materi dibentuk atas empat unsur: tanah, air, api dan udara. Pandangan ini perlahan ditinggalkan, dan akhirnya di abad 17 definisi unsur yang diberikan oleh kimiawan Inggris Robert Boyle (1627-1691) menggantikan definisi lama tadi. Boyle menyatakan bahwa unsur adalah zat yang tidak dapat diuraikan menjadi zat yang lebih sederhana.
Lavoisier mengusulkan daftar unsur dalam bukunya “Traite Elementire de Chemie”. Walaupun ia memasukkan cahaya dan panas dalam daftarnya, anggota lain daftar adalah apa yang kita sebut sebagai unsur sampai saat ini. Selain itu, ia menambahkan pada daftar unsur-unsur yang belum dideteksi tetapi ia yakini keberadaannya. Misalnya, khlorin pada waktu itu belum diisolasi, tetapi ia menambahkannya pada tabel sebagai radikal dari asam muriatik. Demikian juga, natrium dan kalium ada juga dalam tabel.
Di awal abad 19, unsur-unsur ini diisolasi dengan elektrolisis, dan daftar unsur perlahan diperluas. Di pertengahan abad 19, analisis spektroskopi, metoda baru mendeteksi unsur dikenalkan dan mempercepat pertambahan daftar ini. Walaupun disambut gembira oleh kimiawan, masalah masalah baru muncul. Salah satu pertanyaan adalah ‘Apakah jumlah unsur terbatas?’ dan pertanyaan lain adalah ‘Apakah sifat unsur-unsur diharapkan akan mempunyai keteraturan tertentu?’
Penemuan unsur-unsur baru mengkatalisi diskusi-diskusi semacam ini. Ketika iodin ditemukan di tahun 1826, kimiawan Jerman Johann Wolfgang Döbereiner (1780-1849) mencatat kemiripan antara unsur ini dengan unsur yang telah dikenal khlorin dan bromin. Ia juga mendeteksi trio unsur mirip lain. Inilah yang dikenal dengan teori triade Döbereiner.
Triade DöbereinerBanyak ide pengelompokan unsur yang lain yang diajukan tetapi tidak memuaskan masyarakat ilmiah waktu itu. Namun, teori yang diusulkan oleh kimiawan Rusia Dmitrij Ivanovich Mendeleev (1834-1907), dan secara independen oleh kimiawan Jerman Julius Lothar Meyer (1830-1895) berbeda dengan usulan-usulan lain dan lebih persuasif. Keduanya mempunyai pandangan sama sebagai berikut:
Pandangan Mendeleev dan Meyer
- Daftar unsur yang ada waktu itu mungkin belum lengkap.
- Diharapkan sifat unsur bervariasi secara sistematik. Jadi sifat unsur yang belum diketahui dapat diprediksi.
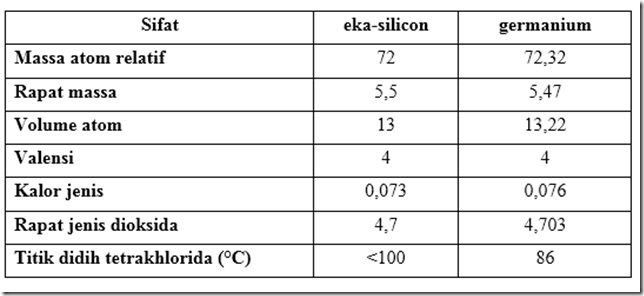
Awalnya teori Mendeleev gagal menarik perhatian. Namun, di tahun 1875, ditunjukkan bahwa unsur baru galium ditemukan oleh kimiawan Perancis Paul Emile Lecoq de Boisbaudran (1838-1912) ternyata bukan lain adalah eka-aluminum yang keberadaan dan sifatnya telah diprediksikan oleh Mendeleev. Jadi, signifikansi teori Mendeleev dan Meyer secara perlahan diterima. Tabel 5.2 memberikan sifat yang diprediksi oleh Mendeleev untuk unsur yang saat itu belum diketahui ekasilikon dan sifat germanium yang ditemukan oleh kimiawan Jerman Clemens Alexander Winkler (1838-1904).
Prediksi sifat unsur eka-silikon oleh Mendeleev dan perbandingannya dengan sifat yang kemudian ditemukan.
Mendeleev mempublikasikan tabel yang dapat dianggap sebagai asal mula tabel periodik modern. Dalam menyiapkan tabelnya, Mendeleev awalnya menyusun unsur berdasarkan urutan massa atomnya, sebagaimana pendahulunya. Namun, ia menyatakan keperiodikan sifat, dan kadang menyusun ulang unsur-unsur, yang berakibat membalikkan urutan massa atom.
Lebih lanjut, situasinya diperumit sebab prosedur menentukan massa atom belum distandarkan, dan kadang kimiawan mungkin menggunakan massa atom yang berbeda untuk unsur yang sama. Dilema ini secara perlahan diatasi setelah International Chemical Congress (Kongres ini diadakan di tahun 1860 di Karlsruhe, Jerman. Tujuan kongres ini untuk mendiskusikan masalah penyatuan massa atom. Dalam kesempatan ini Cannizzaro mengenalkan teori Avogadro pertama yang dihadiri oleh Mendeleev, namun kesukaran-kesukaran tetap ada.
Perkembangan Sistem Periodik Unsur
1. Sistem Periodik Triad Dobereiner
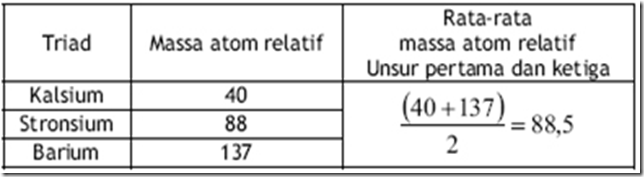
Johann Wolfgang Dobereiner pada tahun 1829 menjelaskan hasil penelitiannya yang menemukan kenyataan bahwa massa atom relatif stronsium berdekatan dengan massa rata-rata dua unsur lain yang mirip dengan stronsium yaitu kalsium dan barium. Hasil penelitiannya juga menunjukkan bahwa beberapa unsur yang lain menunjukkan kecenderungan yang sama. Berdasarkan hasil penelitiannya, Dobereiner selanjutnya mengelompokkan unsur-unsur dalam kelompok-kelompok tiga unsur yang lebih dikenal sebagai triad. Triad yang ditunjukkan oleh Dobereiner tidak begitu banyak sehingga berpengaruh terhadap penggunaannya. Sistem triad ini ternyata ada kelemahannya. Kelemahan dari teori ini adalah pengelompokan unsur ini kurang efisien dengan adanya beberapa unsur lain dan tidak termasuk dalam kelompok triad padahal sifatnya sama dengan unsur dalam kelompok triad tersebut. Kelebihan dari teori ini adalah adanya keteraturan setiap unsur yang sifatnya mirip massa Atom (Ar) unsur yang kedua (tengah) merupakan massa atom rata-rata di massa atom unsur pertama dan ketiga.
2. Sistem Periodik Newlands
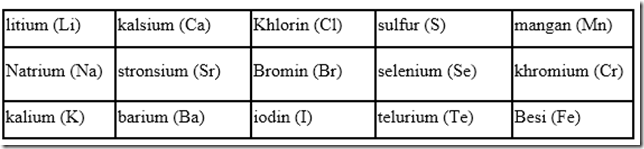
J. Newlands merupakan orang pertama yang mengelompokan unsur-unsur berdasarkan kenaikan massa atom relatif pada tahun 1864. Newlands mengumumkan penemuanya yang di sebut hukum oktaf. Ia menyatakan bahwa sifat-sifat unsur berubah secara teratur. Unsur pertama mirip dengan unsur kedelapan, unsur kedua mirip dengan unsur kesembilan, dan seterusnya. Daftar unsur yang disusun oleh Newlands berdasarkan hukum oktaf. Disebut hukum Oktaf karena beliau mendapati bahwa sifat-sifat yang sama berulang pada setiap unsur ke delapan dalam susunan selanjutnya dan pola ini menyerupai oktaf music.
Kemiripan sifat ditunjukkan oleh unsur yang berselisih satu oktaf yakni unsur ke-1 dan unsur ke-8 serta unsur ke-2 dan unsur ke-9. Daftar unsur yang berhasil dikelompokkan berdasarkan hukum oktaf oleh Newlands ditunjukkan pada tabel berikut.
Hukum oktaf newlands ternyata hanya berlaku untuk unsur-unsur ringan. Jika diteruskan, teryata kemiripan sifat terlalu dipaksakan. Misalnya, Ti mempunya sifat yang cukup berbeda dengan Al maupun B. Kelemahan dari teori ini adalah dalam kenyataanya mesih di ketemukan beberapa oktaf yang isinya lebih dari delapan unsur. Dan penggolonganya ini tidak cocok untuk unsur yang massa atomnya sangat besar.
3. Sistem Periodik Mendeleev
Dmitri Ivanovich Mendeleev pada tahun 1869 melakukan pengamatan terhadap 63 unsur yang sudah dikenal dan mendapatkan hasil bahwa sifat unsur merupakan fungsi periodik dari massa atom relatifnya. Sifat tertentu akan berulang secara periodik apabila unsur-unsur disusun berdasarkan kenaikan massa atom relatifnya. Mendeleev selanjutnya menempatkan unsur-unsur dengan kemiripan sifat pada satu lajur vertikal yang disebut golongan. Unsur-unsur juga disusun berdasarkan kenaikan massa atom relatifnya dan ditempatkan dalam satu lajur yang disebut periode.
Sistem periodik yang disusun Mendeleev dapat dilihat pada tabel berikut:
Mendeleev sengaja mengosong-kan beberapa tempat untuk menetapkan kemiripan sifat dalam golongan. Beberapa kotak juga sengaja dikosongkan karena Mendeleev yakin masih ada unsur yang belum dikenal karena belum ditemukan. Salah satu unsur baru yang sesuai dengan ramalan Mendeleev adalah germanium yang sebelumnya diberi nama ekasilikon oleh Mendeleev.
Hal penting yang terdapat dalam sistem periodik Mendeleev antara lain sebagai berikut:
- Dua unsur yang berdekatan, massa atom relatifnya mempunyai selisih paling kurang dua atau satu satuan;
- terdapat kotak kosong untuk unsur yang belum ditemukan, seperti 44, 68, 72, dan 100;
- dapat meramalkan sifat unsur yang belum dikenal seperti ekasilikon;
- dapat mengoreksi kesalahan pengukuran massa atom relatif beberapa unsur, contohnya Cr = 52,0 bukan 43,3.
a. Kelebihan sistem periodik Mendeleev
- Sifat kimia dan fisika unsur dalam satu golongan mirip dan berubah secara teratur.
- Valensi tertinggi suatu unsur sama dengan nomor golongannya.
- Dapat meramalkan sifat unsur yang belum ditemukan pada saat itu dan telah mempunyai tempat yang kosong.
b. Kekurangan sistem periodik Mendeleev
- Panjang periode tidak sama dan sebabnya tidak dijelaskan.
- Beberapa unsur tidak disusun berdasarkan kenaikan massa atomnya, contoh : Te (128) sebelum I (127).
- Selisih massa unsur yang berurutan tidak selalu 2, tetapi berkisar antara 1 dan 4 sehingga sukar meramalkan massa unsur yang belum diketahui secara tepat.
- Valensi unsur yang lebih dari satu sulit diramalkan dari golongannya.
- Anomali (penyimpangan) unsur hidrogen dari unsur yang lain tidak dijelaskan.
4. Sistem Periodik Moseley (Sistem Periodik Modern)
Pada tahun 1914, Henry G. J. Moseley menemukan bahwa urutan unsur dalam tabel periodik sesuai dengan kenaikan nomor atom unsur. Moseley berhasil menemukan kesalahan dalam tabel periodik Mendeleev, yaitu ada unsur yang terbalik letaknya. Penempatan Telurium dan Iodin yang tidak sesuai dengan kenaikan massa atom relatifnya, ternyata sesuai dengan kenaikan nomor atom.
Henry Moseley melakukan eksperimen pengukuran panjang gelombang unsur menggunakan sinar-X. Berdasarkan hasil eksperimenya tersebut, diperoleh kesimpulan bahwa sifat dasar atom bukan didasari oleh massa atom relatif, melainkan berdasarkan kenaikan jumlah proton. Ha tersebut diakibatkan adanya unsur-unsur yang memiliki massa atom berbeda, tetapi memiliki jumlah proton sama atau disebut isotop.
Kenaikan jumlah proton ini mencerminkan kenaikan nonor atom unsur tersebut. Pengelompokan unsur-unsur sisitem periodik modern merupakan penyempurnaan hukum periodik Mendeleev, yang di sebut juga sistem periodik bentuk panjang. Sistem periodik modern disusun berdasarkan kenaikan nomor atom dan kemiripan sifat. Lajur-lajur horizontal, yang disebut periode disusun berdasarkan kenaikan nomor atom ; sedangkan lajur-lajur vertikal, yang disebut golongan, disusun berdasarkan kemiripan sifat. Sistem periodik modern terdriri atas 7 periode dan 8 golongan. Setiap golongan dibagi lagi menjadi 8 golongan A( IA-VIIIA ) dan 8 golongan B (IB – VIIIB).
Unsur-unsur golongan A disebut golongan utama, sedangkan golongan B disebut golongan transisi. Golongan-golongan juga dapat ditandai dengn bilangan 1 sampai dengan 18 secara berurutan dari kiri ke kanan. Dengan cara ini maka unsur transisi terletak pada golongan 3 sampai golongan 12. Pada periode 6 dan 7 terdapat masing-masing 14 unsur yang disebut unsur-unsur transisi dalam, yaitu unsur-unsur antanida dan aktinida. Unsur-unsur transisi dalam semua termasuk golongan IIIB. Unsur-unsur lantanida pada periode 6 golongan IIIB, dan unsur-unsur aktinida pada periode 7 golongan IIIB. Penempatan unsur-unsur tersebut di bagian bawah tabel periodik adalah untuk alasan teknis, sehingga daftar tidak terlalu panjang.
Periode
Periode ditempatkan pada lajur horizontal dalam sistem periodik modern. Periode suatu unsur menunjukan suatu nomor kulit yang sudah terisi elektron (n terbesar) berdasarkan konfigurasi elektron. Konfiguration elektron adalah persebaran elektron dalam kulit-kulit atomnya. Dalam sistem periodik modern terdapat 7 periode, yaitu :
periode ke-6: terdiri atas 32 unsur yaitu, 18 unsur seperti pada periode 4 atau ke-5, dan 14 unsur lagi merupakan deret lantanida; dan periode ke-7: merupakan periode unsur yang belum lengkap. Pada periode ini terdapat deret aktinida. Golongan unsur pada sistem periodik unsur modern disusun berdasarkan jumlah elektron valensi (elektron yang terletak pada kulit terluar). Unsur dalam satu golongan mempunyai sifat yang cenderung sama dan ditempatkan dalam arah vertikal (kolom).
Pada sistem periodik unsur modern, golongan dibagi menjadi 18 berdasarkan aturan IUPAC. Berdasarkan aturan Amerika, sistem periodik unsur modern dibagi dua golongan yaitu golongan A dan B. Jadi, golongan unsur dari kiri ke kanan ialah IA, IIA, 11113, IVB, VB, VIB, VIIB, VIIIB, IB, 1113, IIIA, IVA, VA, VIA, VIIA, dan VIIIA. Umumnya, digunakan pembagian golongan menjadi A dan B.
Golongan unsur pada sistem periodik unsur modern mempunyai nama khusus yaitu sebagai berikut :
Penetapan Golongan dan Periode
Golongan dan periode dapat ditentukan dengan cara menuliskan konfigurasi elektron. Konfigurasi elektron adalah penataan elektron dalarn atom yang ditentukan berdasarkan jumlah elektron. Pada konfigurasi elektron, jumlah elektron valensi menunjukkan nomor golongan, sedangkan jumlah kulit yang sudah terisi elektron (n terbesar) menunjukkan periode.
Sifat periodik unsur
1. Energi Ionisasi
Bila unsur-unsur disusun sesuai dengan massa atomnya, sifat unsur atau senyawa menunjukkan keperiodikan, dan pengamatan ini berujung pada penemuan hukum periodik. Konfigurasi elektron unsur menentukan tidak hanya sifat kimia unsur tetapi juga sifat fisiknya. Keperiodikan jelas ditunjukkan sebab energi ionisasi atom secara langsung ditentukan oleh konfigurasi elektron. Energi minimum yang dibutuhkan untuk melepas elektron atom netral dalam wujud gas pada kulit terluar dan terikat paling lemah disebut energi ionisasi. Nomor atom dan jari-jari atom mempengaruhi besarnya energi ionisasi. Semakin besar jari-jari atom maka gaya tarik antara inti dengan elektron pada kulit terluar semakin lemah. Hal ini berarti elektron pada kulit terluar semakin mudah lepas dan energi yang dibutuhkan untuk melepaskan elektron tersebut semakin kecil. Akibatnya, dalam satu golongan, energi ionisasi semakin kecil dari atas ke bawah. Sedagkan dalam satu periode, energi ionisasi semakin besar dari kiri ke kanan. Hal ini disebabkan dari kiri ke kanan muatan iti semakin besar yang mengakibatkan gaya tarik antara inti dengan elektron terluar semakin besar sehingga dibutuhkan energi yang besar pula untuk melepaskan elektron pada kulit terluar.
Hubungan energi ionisasi dengan nomor atom
Energi ionisasi pertama, energi yang diperlukan untuk memindahkan elektron pertama, menunjukkan keperodikan. Untuk periode manapun, energi ionisasi meningkat dengan meningkatnya nomor atom dan mencapai maksium pada gas mulia. Energi ionisasi semakin besar apabila makin banyak elektron yang dilepaskan oleh suatu atom.Dalam golongan yang sama energi ionisasi menurun dengan naiknya nomor atom. Kecenderungan seperti ini dapat dijelaskan dengan jumlah elektron valensi, muatan inti, dan jumlah elektron dalam. Kurva tersebut menunjukkan unsur golongan 8A berada di puncak grafik yang mengindikasikan bahwa energi ionisasinya besar. Hal sebaliknya terjadi untuk unsur golongan 1A yang berada di dasar kurva yang menunjukkan bahwa energi ionisasinya kecil. Atom suatu unsur dapat melepaskan elektronnya lebih dari satu buah. Energi yang dibutuhkan untuk melepaskan elektron kedua disebut energi ionisasi kedua dan tentu saja diperlukan energi yang lebih besar. Energi ionisasi kedua dan ketiga didefinisikan sebagai energi yang diperlukan untuk memindahkan elektron kedua dan ketiga.
2. Afinitas elektron
Afinitas elektron merupakan energi yang dilepaskan atau diserap oleh atom netral dalam bentuk gas apabila terjadi penangkapan satu elektron yang ditempatkan pada kulit terluarnya dan atom menjadi ion negatif. Afinitas elektron dapat berharga positif dan negatif. Afinitas elektron berharga negatif apabila dalam proses penangkapan satu elektron, energi dilepaskan. Ion negatif yang terbentuk akibat proses tersebut bersifat stabil. Hal sebaliknya terjadi apabila dalam proses penangkapan satu elektron, energi diserap. Penyerapan energi menyebabkan ion yang terbentuk bersifat tidak stabil. Semakin negatif harga afinitas lektron suatu atom unsur maka ion yang ter bentuk semakin stabil.
Afinitas elektron golongan 1, 2, 3, 4, 5, 6 dan 7
Afinitas elektron terbesar dimiliki oleh unsur golongan halogen karena unsur golongan ini paling mudah menangkap elektron. Jadi secara umum dapat dikatakan bahwa afinitas elektron, dalam satu periode, dari kiri ke kanan semakin negatif dan dalam satu golongan dari atas ke bawah, semakin positif. Afinitas elektron didefinisikan sebagai kalor reaksi saat elektron ditambahkan kepada atom netral gas, yakni dalam reaksi.
F(g) + e¯ → F¯(g)
Nilai positif mengindikasikan reaksi eksoterm, negatif menunjukkan reaksi endoterm. Karena tidak terlalu banyak atom yang dapat ditambahi elektron pada fasa gas, data yang ada terbatas jumlahnya dibandingkan jumlah data untuk energi ionisasi. Tabel berikut menunjukkan bahwa afinitas elektron lebih besar untuk non logam daripada untuk logam.
3. Keelektronegatifan
Keelektronegatifan adalah skala yang dapat menjelaskan kecenderungan atom suatu unsur untuk menarik elektron menuju kepadanya dalam suatu ikatan. Keelektronegatifan secara umum, dalam satu periode, dari kiri ke kanan semakin bertambah dan dalam satu golongan, dari atas ke bawah keelekrnegatifan semakin berkurang. Hal ini dapat dimengerti karena dalam satu periode, dari kiri ke kanan, muatan inti atom semakin bertambah yang mengakibatkan gaya tarik antara inti atom dengan elektron terluar juga semakin bertambah. Fenomena ini menyebabkan jari-jari atom semakin kecil, energi ionisasi semakin besar, afinitas elektron makin besar dan makin negatif dan akibatnya kecenderungan untuk menarik elektron semakin besar.
Terlihat dari gambar bahwa untuk unsur gas mulia tidak mempunyai harga keelektronegatifan karena konfigurasi elektronnya yang stabil. Stabilitas gas mulia menyebabkan gas mulia sukar untuk menarik dan melepas elektron. Keelektronegatifan skala pauling memberikan nilai keelektronegatifan untuk gas mulia sebesar nol.
Apapun skala keelektronegativan yang dipilih, jelas bahwa keelektronegativan meningkat dari kiri ke kanan dan menurun dari atas ke bawah. Keelketroegativan sangat bermanfaat untuk memahami sifat kimia unsur. Perbedaan keelektronegativan antara dua atom yang berikatan, walaupun hanya semi kuantitatif, berhubungan erat dengan sifat ikatan kimia seperti momen dipol dan energi ikatan. Misalnya ada distribusi muatan yang tidak sama dalam ikatan A-B (xA > xB). Pasangan muatan positif dan negatif ±q yang dipisahkan dengan jarak r akan membentuk dipol (listrik).
Arah dipol dapat direpresentasikan dengan panah yang mengarah ke pusat muatan negatif dengan awal panah berpusat di pusat muatan positif. Besarnya dipol, rq, disebut momen dipol. Momen dipol adalah besaran vektor dan besarnya adalah µ dan memiliki arah.
Besarnya momen dipol dapat ditentukan dengan percobaan tetapi arahnya tidak dapat. Momen dipol suatu molekul (momen dipol molekul) adalah resultan vektor momen dipol ikatan-ikatan yang ada dalam molekul. Bila ada simetri dalam molekul, momen dipol ikatan yang besar dapat menghilangkan satu sama lain sehingga momen dipol molekul akan kecil atau bahkan nol.
4. Jari-jari Atom
Jari-jari atom adalah jarak elektron di kulit terluar dari inti atom. Jari-jari atom sulit untuk ditentukan apabila unsur berdiri sendiri tanpa bersenyawa dengan unsur lain. Jari-jari atom secara lazim ditentukan dengan mengukur jarak dua inti atom yang identik yang terikat secara kovalen. Pada penentuan jari-jari atom ini, jari- jari kovalen adalah setengah jarak antara inti dua atom identik yang terikat secara kovalen.
Penentuan jari-jari atom
Kurva hubungan jari-jari atom dengan nomor atom memperlihatkan bahwa jari-jari atom dalam satu golongan akan semakin besar dari atas ke bawah. Hal ini terjadi karena dari atas ke bawah jumlah kulit bertambah sehingga jari-jari atom juga bertambah.
Unsur-unsur dalam satu periode (dari kiri ke kanan) berjumlah kulit sama tetapi jumlah proton bertambah sehingga jari-jari atom juga berubah. Karena jumlah proton bertambah maka muatan inti juga bertambah yang mengakibatkan gaya tarik menarik antara inti dengan elektron pada kulit terluar semakin kuat. Kekuatan gaya tarik yang semakin meningkat menyebabkan jari-jari atom semakin kecil. Sehingga untuk unsur dalam satu periode, jari-jari atom semakin kecil dari kiri ke kanan.
Jari-jari ion digambarkan sebagai berikut:
5. Kereaktifan
Reaktif artinya mudah bereaksi. Unsur-unsur logam pada sistem periodik, makin ke bawah makin reaktif, karena makin mudah melepaskan elektron. Unsur-unsur bukan logam pada sistem periodik, makin ke bawah makin kurang reakatif, karena makin sukar menangkap elektron. Kereaktifan suatu unsur bergantung pada kecenderungannya melepas atau menarik elektron. Jadi, unsur logam yang paling reatif adalah golongan VIIA (halogen). Dari kiri ke kanan dalam satu periode, mula-mula kereaktifan menurun kemudian bertambah hingga golongan VIIA. Golongan VIIA tidak rekatif.
6. Titik Didih dan Titik Leleh
Dalam satu periode, titik cair dan titik didih naik dari kiri ke kanan sampai golongan IVA, kemudian turun drastis. Titik cair dan titik didih terendah dimiliki oleh unsur golongan VIIIA.
Dalam satu golongan, ternyata ada dua jenis kecenderungan:
a) Unsur-unsur golongan IA – IVA, titik cair dan titik didih makin rendah dari
atas ke bawah
Unsur-unsur golongan VA – VIIIA, titik cair dan titik didihnya makin tinggi.
DAFTAR PUSTAKA
http:/ www.chem-is-try.org/kategori/materi_kimia/kimia.../sistem_periodik/
http:/www.chem-is-try.org/sistem_periodik_unsur
http:/ www.chem-is-try.org/materi...x/perkembangan-pengelompokan-unsur/
http:/www.chem-is-try.org/materi_kimia/.../sistem_periodik/sifat-periodik-unsur/
http:/www.findtoyou.com/pariodik_unsur
http:/www. wikipedia.org/wiki/tabel_periodik







![clip_image002[1] clip_image002[1]](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEiPiGk_e-5ZSvr1Ply6_ahG34_205Sxp8Ycnmh8qPVilWTRlKFgXUjMgq-FvsLKcB9ZEQxHVjcTt5OE6jY02KiT5_MvAsRMJrNGwAnUtezkuUbOZIUJNnezFNdzOMqtuTmdwXA9-uah_O4/?imgmax=800)
![clip_image004[4] clip_image004[4]](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEjnQ1NtRUaVKy3ITyEIL9W1ZJa0k6s5XTI7H7JLvKjk0P7SOK0usMkJl7yz4QTY12mi7d4gONZDOSTHjN_X73z2lgbHiPFTT2Y7l07y6Swkx_8HcFy_dSbRfFOW18FHXC9QFg68NyhFvd8/?imgmax=800)
![clip_image002[3] clip_image002[3]](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEiTwuBZinCCQRhb4WA1_BOd_-LtMgF70RAeAX4-Du1KyZ11EJtm2bX6AcLWMpSqVpee8GNmMITDMQlB8ACzEdBd7zTs0PQVrrjKVbxQcDyvwka_QmT28PMlGlSH5tdhGVKfsFaCNMvjrJU/?imgmax=800)
![clip_image001[4] clip_image001[4]](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEhmTPr-_par6tZa9YjGZ_dHwsbcAJyfY6D-p8vEjkQIaAKkozylrK3OdAG04_SACG-qq6Zt2FPIjYLXxb52f0r3ZQgtuu4Ug83Ladvb-mGYXBprzLoMHeHoMvYTg88_NglApumw1vv1m3w/?imgmax=800)
![clip_image002[5] clip_image002[5]](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEjaT5vxCu3CCgAhNyQfRBA-bRtVyvD0X8KpUFGTTc21oUG4xL6Vo-8yvje8YMsQ_5TyjrbHc3hDN1f4JwpkHtxoQWiFXdcRQj4zf9XgVJaIVA_StA1mlSDfMrqaNLF2jH8kFW4CHn-ONHs/?imgmax=800)
![clip_image004[6] clip_image004[6]](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEjquItqiNkrz1RTQxyjKv9wD6m3mueozIleN7-60pOAramWCAzoA6ycYVU87rkaXushab3rBqirgcag9YbhAOpEobBOw0m25uiyISkVsQb7xDINgeaxwy0eh05Fr5-_2J0ARM1vVRhgYlQ/?imgmax=800)

Komentar
Posting Komentar